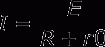铅酸蓄电池充放电原理,铅酸蓄电池充放电的化学变化
来源:电工天下时间:2016-02-12 07:41:26 作者:老电工手机版>>
铅酸蓄电池充放电的原理说明
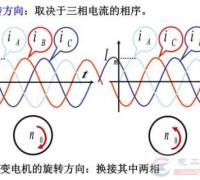
铅酸蓄电池内的阳极(Pb02)及阴极((Pb) 浸到电解液(稀硫酸)中,两极间会产生2V的电力,这是根据铅蓄电池原理,经过充放电,则阴阳极及电解液即会发生如下的变化:
(阳极)(电解液)(阴极)
PbO2+2H2SO4+Pb->PbSO4+2H20+PbSO4(放电反应)
(过氧化铅)(硫酸)(海绵状铅)
(阳极)(电解液)(阴极)
PbSO4+2H20+PbSO4->Pb02+2H2SO4+Pb(充电反应)
(硫酸错)(水)(硫酸铅)
1、放电中的化学变化
蓄电池连接外部电路放电时,稀硫酸即会与阴、阳极板上的活性物质产生反应,生成新化合物“硫酸铅”.经由放电硫酸成分从电解液中释出,放电愈久,硫酸浓度愈稀薄。所消耗之成份一与放电量成比例,只要测得电解液中的硫酸浓度,亦即测其比重,即可得知放电量或残余电量。
2、充电中的化学变化
由于放电时在阳极板,阴极板上所产生的硫酸铅会在充电时被分解还原成硫酸,铅及过氧化铅。
因此,电池内电解液的浓度逐渐增加。亦即电解液之比重上升,并逐渐回复到放电前的浓度,这种变化显示出蓄电池中的活性物质己还原到可以再度供电的状态,当两极的硫酸铅被还原成原来的活性物质时,即等于充电结束,而阴极板就产生氢,阳极板则产生氧,充电到最后阶段时,电流几乎都用在水的电解,因而电解液会减少,此时应以纯水补充之。
相关文章放电线圈试验项目与周期要求图解

有关放电线圈试验项目与周期要求,通过本例了解放电线圈试验的具体项目,检查周期的具体要求等,需要的朋友参考下。
时间:2022-09-12 12:51:18
气体和固体之间的沿面放电是什么
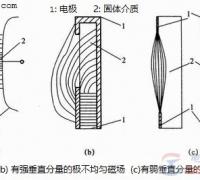
带电作业工具和空气交界面上出现放电现象,称为沿面放电。沿面放电发展成贯穿性的空气击穿,称为闪络。沿面放电是一种气体放电现象,由于介质分界面上的电场强度分布不均匀,沿面闪络电压比气体或固体单独存在时的击穿电压都低。
时间:2022-06-23 20:01:52
铅蓄电池的构造组成及功能
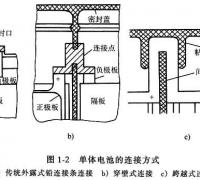
有关铅蓄电池的构造组成与功能说明,铅蓄电池主要由极板、隔板、壳体、电解液、铅连接条、极柱等部分组成,并介绍了单体电池的串接方式。
时间:2020-10-27 16:07:22
过度放电锂电池的修复电路说明
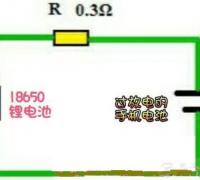
过度放电的手机锂电池,在锂电池内部的保护板会处于输出关闭状态,即便是用原装的手机充电器长时间充电,也不能使电池恢复正常,此时可以取出电池,对过度放电锂电池进行修复,这里分享了过度放电锂电池的修复电路,供大家参考。
时间:2020-10-27 14:32:26
局部放电测量干扰四种排除方法
如何排除局部放电测量干扰,局部放电测试中的干扰及抗干扰措施,包括局放干扰的来源,局放干扰的分类,常用的抑制干扰方法等,一起来了解下。
时间:2020-06-23 10:37:53
蓄电池容量受哪些因素影响?
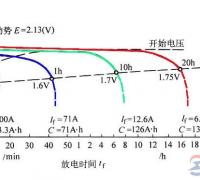
蓄电池容量的影响因素,一是与生产工艺及产品结构有关的因素,二是使用条件,包括放电电流、电解液温度和电解液相对密度等。
时间:2020-01-13 13:39:19
蓄电池怎么串联?蓄电池串联并联方法图解

有关蓄电池怎么串联的方法,多个蓄电池连接方式分为串联和并联两种,本节重点介绍蓄电池串联方法与接线图,以及蓄电池串联和并联的区别,蓄电池的串联与并联的注意事项。
时间:2020-01-08 21:43:44
电气设备局部放电特征与局部放电的分类(图文)

本文介绍了电气设备局部放电特征及原理,局部放电是指发生在电极之间但并未贯穿电极的放电,局部放电是一种复杂的物理过程,局部放电的发生机理是什么,局部放电的三种分类。
时间:2017-08-26 09:20:31