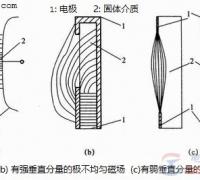
蓄电池的工作原理,蓄电池的充放电方法图解
蓄电池的工作原理与充电放电方法
蓄电池是由浸渍在电解液中的正极板(二氧化铅Pb02)和负极板(海绵状纯铅Pb)组成的,电解液是硫酸(H2S04)的水溶液。
当蓄电池和负载接通放电时,正极板上的Pb02 和负极板上的Pb都变成PbS04,电解液中的H2S04减少,相对密度下降。
充电时按相反的方向变化,正负极板上的PbS04分别恢复成原来的Pb02和Pb,电解液中的硫酸增加,相对密度变大。如略去中间的化学反应过程,可用下式表示:
Pb02+Pb十2H2S04=2PbS04+2H20 (1—1)
1、电势的建立
当极板浸入电解液时,在负极板处,金属铅受到两方面的作用,一方面它有溶解于电解液的倾向,因而有少量铅进入溶液,生成Pb2+,在极板上留下两个电子2e,使极板带负电;另一方面,由于正、负电荷的吸引,Pb2+有沉附于极板表面的倾向。当两者达到平衡时,溶解便停止,此时极板具有负电位,约为-0.1V。
正极板处,少量Pb02溶入电解液,与水生成Pb(OH):,再分离成四价铅离子和氢氧根离子。
即
Pb02+2H20---->Pb(OH)4
Pb(OH)4=Pb4++4(OH)-
由于Pb4+沉附于极板的倾向,大于溶解的倾向,因而沉附在正极板上,使极板呈正电位。当达到平衡时,约为+2.0V。
因此,当外电路未接通,反应达到相对平衡状态时,蓄电池的静止电动势约为:
E0=2.0-(-0.1)=2.1V
2、铅蓄电池的放电
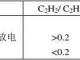
当蓄电池接上负载后,在电动势的作用下,电流从正极经过负载流往负极(即电子从负极到正极),使正极电位降低,负极电位升高,破坏了原有的平衡。放电时的化学反应过程如图1—3所示。
在正极板处,Pb4+和电子结合,变成二价铅离子Pb2+,Pb2+与电解液中的SO42-结合生成PbS04沉附于极板上。
即
Pb4++2e----> Pb2+
Pb2++ SO42-=PbSO4
在负极板处,Pb2+与电解液中的SO42-结合也生成PbS04沉附在负极板上,而极板上的金属铅继续溶解,生成Pb2+和电子。如果电路不中断,上述化学反应将继续进行,使正极板上的Pb02和负极板上的Pb都逐渐转变为PbS04,电解液中的PbS04逐渐减少而水增多,故电解液相对密度下降。
理论上,放电过程应进行到极板上的活性物质全部变为硫酸铅为止,而实际上是不可能的,因为电解液不能渗透到活性物质的最内层。
使用中,所谓放完电的蓄电池,实际上只有20%~30%的活性物质变成了硫酸铅,因此采用薄型极板,增加多空率,提高极板活性物质的利用率可提高蓄电池的容量,也是蓄电池工业的发展方向。
3、铅蓄电池的充电
充电时,应将蓄电池接直流电源。
当电源电压高于蓄电池电动势时,在直流电源电压作用下,电流从蓄电池正极流人,负极流出(即驱使电子从正极经外电路流人负极)。这时正负极板发生的反应正好与放电过程相反,其化学反应过程如图1—4。
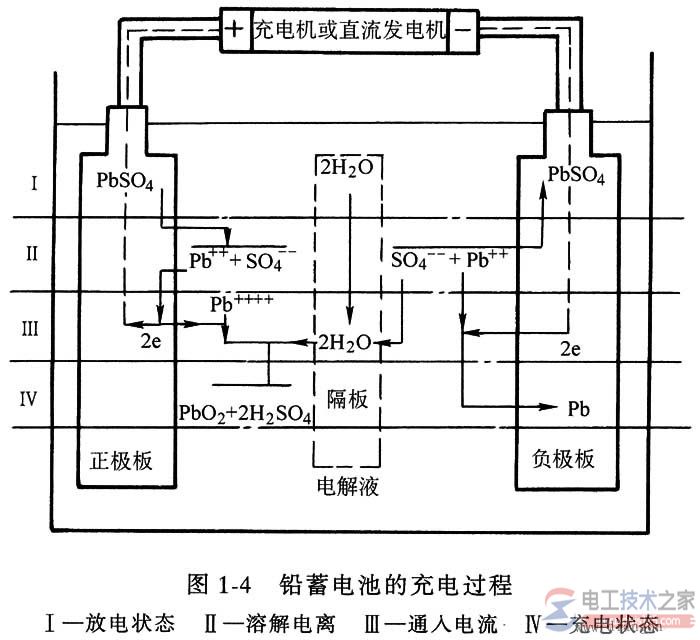
在负极板处有少量的PbS04进入电解液中,离解为Pb2+和SO42-。
Pb2+在电源的作用下获得两个电子变为金属Pb,沉附在极板上。
而SO42-则与电解液中的H+结合,生成硫酸。
即:
PbS04---->Pb2++SO42-
Pb2++2e---->Pb
SO42-+2H+---->H2S04 (1—3)
负极板上总的反应式为:
PbS04+2e+2H+---->Pb+H2SO4 (1—4)
正极板处,也有少量PbS04进入电解液中,离解为Pb2+和SO42-,Pb2+在电源作用下失去两个电子变为Pb4+,它又和电解液中水离解出来的OH—结合,生成Pb(OH)4,Pb(OH)4又分解为Pb02和H20,而SO42-又与电解液中的H+结合生成硫酸。
其反应式:
PbS04----> Pb2++ SO42-
Pb2+-2e----> Pb4+
4H20---->4H++4OH—
Pb4++4 OH—---->Pb(OH)4
Pb(OH)4----> Pb02+2H20
2SO42-+4H+----> 2H2S04
正极板上的总反应为:
PbS04—2e+2H20+ SO42----->Pb02+2H2S04 (1—5)
可见,在充电过程中,正负极板上的PbS04将逐渐恢复为Pb02和Pb,电解液中硫酸成分逐渐增多,水逐渐减少。
充电终期,密度将升到最大值,且会引起水的分解,水分解的化学反应式:
2H2S04 ---->4H++ SO42-
负极上:4H++4e---->2H2
正极上:2SO42--4e+2H20---->2H2S04+O2
总反应为:2H2S04+2H20---->2H2S04十2H2+O2(1—6)
由上式可见,实际上分解的是水:2H20---->2H2+02 (1—7)
本站仅提供信息发布平台,文章仅代表作者个人观点。